设计医疗器械包装需要参考哪些法律法规要求?
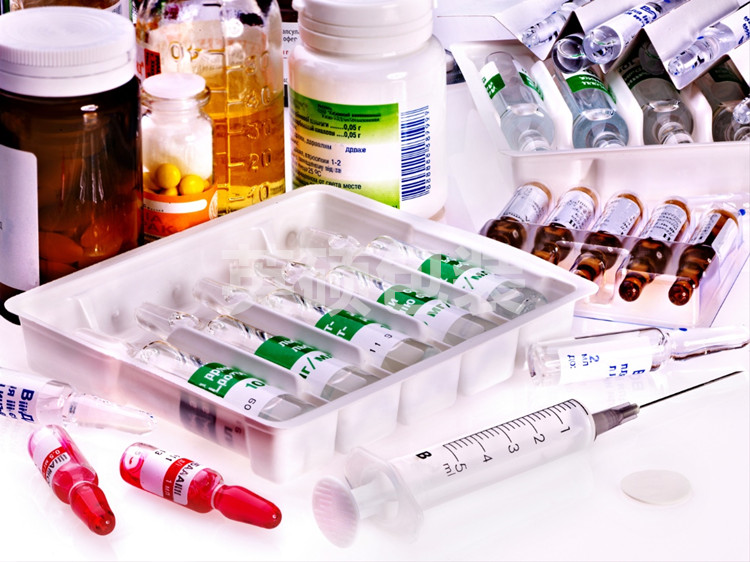
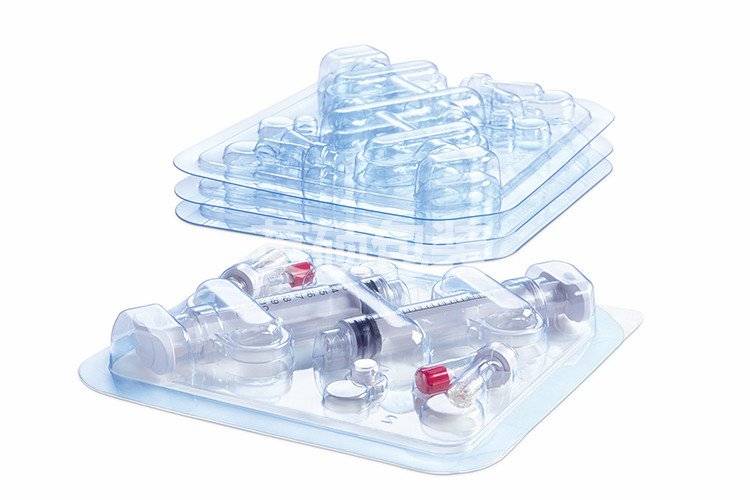
理想医疗器械包装的设计以及保证无菌屏障系统的完整性是一个将医疗器械安全可靠的投放市场的一个重要的组成部分。然而,在整个产品开发过程中,这一个关键的过程却通常很少受到关注。大多数医疗器械商都希望可以很自信的说他们的医疗器械包装在其保质期内打开的时候可以保持无菌状态,但麻烦的是怎么去证明这一点。下面就有英硕包装来告诉大家。

ISO11607-1 2006《最终灭菌医疗器械的包装》是医疗器械包装的主要参考法规,其中包含了ASTM和ISTA等一系列符合ISO11607的特定测试方法。对于特定的医疗器械包装系统相关的指导,企业必须严格按照ISO11607的标准,以确保使用适当的测试方式。在测试之前明确理解包装是否能通过测试的标准对于理想包装设计的成功是至关重要的。
最新产品
同类文章排行
- 医用吸塑盒不透气材料测试参考标准
- 不同维度来了解医用吸塑盒与普通吸塑盒的差别
- 医用硬质吸塑盒的材质选择简述
- 医疗器械包装验证的内容和方法参考
- 最终医疗器械包装评审需注意些什么?
- 医用吸塑盒设计过程当中,应当注意些什么?
- 医疗器械常见的包装方式医用硬质包装加盖材
- 如何给医疗器械选择合适的包装
- 关于医疗包装定制PET能否与特卫强热封的问题
- 医用纸塑包装的组成结构和使用时注意事项
最新资讯文章
您的浏览历史







 粤公网安备 44190002005415号
粤公网安备 44190002005415号